Aufgrund der wachsenden Zahl alter und sehr alter Menschen in den Industrieländern wird auch die absolute Zahl der Frakturen in den kommenden Jahrzehnten wesentlich steigen; ein Trend, der nur dann rückgängig gemacht werden kann, wenn die Prävention und die rechtzeitige Diagnose und Therapie mehr Aufmerksamkeit erhalten.
Die beiden wichtigsten zugrunde liegenden Mechanismen von Frakturen sind Osteoporose und Stürze [1]. Dabei sind Oberschenkel-Frakturen die häufigsten und kostenintensivsten, Frakturen des Beckens die tödlichsten. Die Arbeitsgruppe um Bleibler rechnet, dass in Deutschland die Zahl von Osteoporose-bedingten Frakturen von 115.248 aus dem Jahre 2010 bis zum Jahre 2050 auf 273.794 anwachsen wird. Kumuliert sind das etwa 8,1 Millionen Frakturen (78 % Frauen, 22 % Männer). Die Kosten werden von etwa 1 Milliarde in 2010 auf 6,1 Milliarden Euro in 2050 steigen. Kumuliert sind das etwa 88,5 Milliarden Euro. Der Verlust an QALYs (quality adjusted life years) liegt bei etwa 2,5 Millionen [2]. Im Jahr 2010 wurde die Zahl der Todesfälle in der Europäischen Union im Zusammenhang mit osteoporotischen Frakturen auf etwa 43.000 geschätzt [3].
Was sind
Osteopenie
und
Osteoporose?
Osteopenie (Vorstufe) und Osteoporose sind systemische Erkrankung des Skeletts, die durch eine reduzierte Knochenmasse, eine Verschlechterung der Mikroarchitektur des Knochengewebes und eine erhöhte Knochenbrüchigkeit gekennzeichnet sind [4]. Diese Knochenpathologie kann in primäre oder sekundäre Formen klassifiziert werden. Die primäre Osteoporose ist durch einen progressiven, altersbedingten Mineralienverlust des Knochens gekennzeichnet, der vor allem durch Veränderungen im Sexualhormon-Haushalt beeinflusst wird.
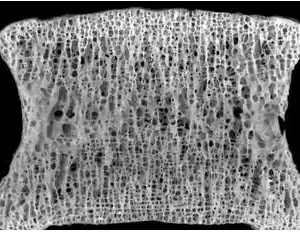
Gesunder Wirbelkörper
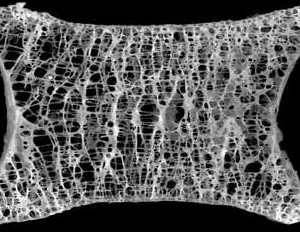
Wirbelkörper mit Osteopenie
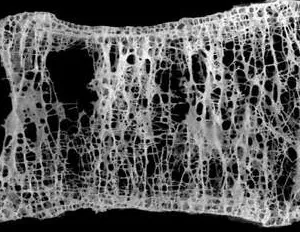
Wirbelkörper mit Osteoporose
Hier wird wiederum zwischen einer postmenopausalen (Typ I) oder einer senilen Osteoporose (Typ II) unterschieden. Die Typ-I Patienten sind Frauen, in der Regel zwischen 50 und 65 Jahren, mit Östrogenmangel und einer progressiven trabekulären Knochenresorption vor allem in Wirbelsäule und Handgelenken. Im Gegensatz dazu ist die senile Osteoporose Typ II durch einen ausgeglichenen Verlust von kortikalen und spongiösen Bereichen des Knochengewebes gekennzeichnet. Charakteristische Typ II-Osteoporose-Frakturen sind Brüche des proximalen Humerus, der Tibia, der Hüfte und des Beckens [5].
Altersspezifische Häufigkeit von Osteopenie und Osteoporose
| Alter |
Normale BMD
Männer (%) |
Normale BMD
Frauen (%) |
Osteopenie
Männer (%) |
Osteopenie
Frauen (%) |
Osteoporose
Männer (%) |
Osteoporose
Frauen (%) |
| 65-69 |
20,1 |
22,3 |
65,8 |
60,5 |
14,1 |
17,2 |
| 70-74 |
22,3 |
15,5 |
64,4 |
62,2 |
13,3 |
22,3 |
| 75-79 |
20,9 |
12,2 |
59,9 |
57,8 |
19,2 |
30,0 |
| 80-84 |
19,2 |
11,3 |
58,3 |
54,4 |
22,5 |
34,3 |
| 85+ |
12,1 |
6,5 |
51,5 |
48,4 |
36,4 |
45,2 |
Alter
(Jahre) |
Normale BMD
Männer (%) |
Normale BMD
Frauen (%) |
| 65-69 |
20,1 |
22,3 |
| 70-74 |
22,3 |
15,5 |
| 75-79 |
20,9 |
12,2 |
| 80-84 |
19,2 |
11,3 |
| 85+ |
12,1 |
6,5 |
Alter
(Jahre) |
Osteopenie
Männer (%) |
Osteopenie
Frauen (%) |
| 65-69 |
65,8 |
60,5 |
| 70-74 |
64,4 |
62,2 |
| 75-79 |
59,9 |
57,8 |
| 80-84 |
58,3 |
54,4 |
| 85+ |
51,5 |
48,4 |
Alter
(Jahre) |
Osteoporose
Männer (%) |
Osteoporose
Frauen (%) |
| 65-69 |
14,1 |
17,2 |
| 70-74 |
13,3 |
22,3 |
| 75-79 |
19,2 |
30,0 |
| 80-84 |
22,5 |
34,3 |
| 85+ |
36,4 |
45,2 |
Alters- und geschlechtsspezifische Verteilung von Osteoporose und Osteopenie. Abk.: BMD = Bone Mineral Density | Knochenmineraldichte. Quelle: Benzinger P, et al. BMC Geriatr. 2016; 16: 75. [1]
Osteoporose bei Männern
Osteoporose wurde lange Zeit als eine Frauen-Krankheit betrachtet, allerdings steigen alterungsbedingte Frakturen auch bei Männern an. Die genaue Zahl erkrankter Männer ist jedoch unbekannt, vermutlich aufgrund der geringeren Screening-Häufigkeit und Prüfung der Knochenmineraldichte (BMD). Je nach Land werden bisher unterschiedliche Schätzdaten angenommen: So z. B. in den USA etwa 1-2 Millionen Männer [6]. In Dänemark wurden in einer Stichprobe von 600 Männern (60 und 75 Jahre) 10,2 % mit Osteoporose diagnostiziert [7]. Insgesamt wird angenommen, dass etwa die Hälfte aller Frauen und ein Viertel aller Männer über 50 Jahre eine osteoporotische Fraktur erleiden werden [4].
Niereninsuffizienz und Sturzrisiko
Alte Menschen haben nach schweren Stürzen eine schlechte Prognose. Die Arbeitsgruppe um Bowling untersuchte, ob sich die Mortalität aufgrund von schweren Stürzen bei niereninsuffizienten Patienten (≥ 65 Jahre) erhöht. Dabei wurden die Daten von 2.590 Patienten mit Niereninsuffizienz (eGFR < 60 ml / min pro 1,73 m² oder Albumin-Kreatinin-Verhältnis ≥ 30 mg/g) analysiert. Schwere Sturz-Verletzungen wurden als sturzbedingten Fraktur, Gehirnverletzung oder Luxation definiert und die kumulative Mortalität mit einer altersentsprechenden Kontrollgruppe verglichen. Bowling et al. konnten zeigen, dass bei niereninsuffizienten Patienten die kumulative 1-Jahres-Mortalitätsrate nach einem schweren Sturz mit 21 % deutlich höher war als bei der Kontrollgruppe (5,5 %). Dabei war das Sturzrisiko vor allem mit einem erhöhten Albumin-Kreatinin-Verhältnis verbunden [8].
Hüftfrakturen mit schlechter Prognose
Die Auswirkungen von Frakturen auf das Überleben hängen von der Art der Fraktur ab. Hüftfrakturen sind am gefährlichsten, da etwa 10-20 % der Frauen mit einer Hüftfraktur innerhalb des ersten Jahres sterben. Und zwar deutlich früher als für das erreichte Alter zu erwarten wäre. Auch bei Männern ist die Sterblichkeit höher, obwohl die Sterblichkeitsraten nach Hüftfrakturen in den letzten 20 Jahren konstant geblieben zu sein scheinen. Dabei ist das Sterberisiko unmittelbar nach der Fraktur am höchsten und nimmt im Laufe der Zeit ab. Osteoporosebedingte Frakturen führen sehr häufig zu einer Beeinträchtigung der körperlichen Funktionsfähigkeit, einschließlich des Verlustes der Mobilität und der Fähigkeit, sich selbst zu versorgen. Etwa 7 % der Frauen sind bei den grundlegenden Aktivitäten des täglichen Lebens auf die Hilfe anderer angewiesen, weitere 8 % müssen in einem Pflegeheim untergebracht werden. Die größte langfristige Beeinträchtigung betrifft die Gehfähigkeit: Die Hälfte der Patienten, die vor der Fraktur gehen konnten, sind nach der Fraktur nicht mehr in der Lage, selbständig zu gehen. Darüber hinaus kann bis zu einem Drittel der Menschen, die eine Hüftfraktur erleiden, vollständig pflegebedürftig werden [4].
Weitere Risikofaktoren für Frakturen
Mehrere Faktoren tragen wesentlich zum Frakturrisiko bei, das über das durch Knochenmineraldichte-Messungen ermittelte Risiko hinausgeht. Nach den Richtlinien der "European Society for Clinical and Economic Aspects of Osteoporosis und Osteoarthritis" (ESCEO) und dem "Committees of Scientific Advisors and National Societies of the International Osteoporosis Foundation" (IOF) [9] gehören dazu Alter, Geschlecht, niedriger Body-Mass-Index, frühere Frakturen, elterliche Vorgeschichte einer Hüftfraktur, Behandlung mit Glukokortikoiden, Rauchen, Alkoholkonsum und die Ursachen für eine sekundäre Osteoporose.
Weitere Risikofaktoren, die bei der Beurteilung des Risikos von Nutzen sind, sind eine Reduktion der Körperlänge (> 4 cm) und eine pathologische Brustkyphose. Eine pathologische Kyphose der Brustwirbelsäule liegt ab einer dorsal-konvexen Krümmung der Wirbelsäule von über 40° vor [9].
Auch Knochenmarker (Serumprokollagen Typ I N-Propeptid (s-PINP) und Serum-C-terminales quervernetzendes Telopeptid des Typ I-Kollagens (s-CTX) als Marker der Knochenbildung bzw. der Knochenresorption) haben eine gewisse prognostische Bedeutung, wenn eine BMD nicht verfügbar ist [9].
Osteorenale Kommunikation
Knochen sind Zielorgane für verschiedene Hormone, wie Parathormon (PTH), Vitamin D, Calcitonin und Sexualhormone. PTH und Vitamin D beeinflussen erheblich den Serum-Calcium- sowie -Phosphat-Spiegel und damit Knochen-Bildung und -Abbau. Die Synthese und Freisetzung dieser beiden Hormone wird hauptsächlich durch den Serum-Calcium-Spiegel geregelt [10]. Bei normaler Nierenfunktion wandelt die Niere den Vitamin D-Metaboliten 25-Hydroxyvitamin D3 (25(OH)D₃) in 1,25(OH)₂D₃ (aktives Vitamin D3, Calcitriol) um. Das dabei entstehende aktive Vitamin D stimuliert die Absorption von Calcium und Phosphat im Darm sowie die Reabsorption in der Niere und die Mobilisierung aus den Knochen [11].
25(OH)D₃-Spiegel in der deutschen Bevölkerung
| Alter |
<30 nmol/l |
30-<50 nmol/l |
50-<75 nmol/l |
≥75 nmol/l |
| Frauen (18-44 Jahre) |
28,9 % |
27,0 % |
26,6 % |
17,5 % |
| Frauen (45-64 Jahre) |
28,8 % |
34,5 % |
27,9 % |
8,9 % |
| Frauen (65-79 Jahre) |
32,9 % |
36,9 % |
24,4 % |
5,7 % |
| Frauen (gesamt) |
29,7 % |
31,8 % |
26,6 % |
11,9 % |
| Männer (18-44 Jahre) |
32,8 % |
28,7 % |
24,2 % |
14,2 % |
| Männer (45-64 Jahre) |
30,4 % |
31,1 % |
28,3 % |
10,2 % |
| Männer (65-79 Jahre) |
26,6 % |
36,0 % |
29,1 % |
8,2 % |
| Männer (gesamt) |
30,8 % |
30,9 % |
26,6 % |
11,6 % |
| Gesamt-Bevölkerung |
30,2 % |
31,3 % |
26,6 % |
11,8 % |
Alters- und geschlechtsspezifische Verteilung der 25(OH)D₃-Spiegel in der deutschen Bevölkerung. Quelle: Rabenberg M, et al. BMC Public Health. 2015; 15: 641.
Parathyreoidhormon (PTH) und Niereninsuffizienz
Bei chronischer Niereninsuffizienz kommt es bereits früh zu einem Calcitriol-Defizit und einer Phosphatretention, die durch den Verlust der glomerulären Filtrationsrate (GFR) und durch einen relativen Vitamin D-Mangel bedingt sein kann. Infolge des Vitamin D-Mangels und der Hyperphosphatämie entwickelt sich eine Hypokalzämie (Serum-Kalzium unter 2,2-2,65 mmol/l). Eine Hypokalzämie signalisiert der Nebenschilddrüse PTH auszuschütten, welches wiederum die 1α-Hydroxylase des 25(OH)D₃ (25-Hydroxyvitamin D3, Cholecalciferol, Calcifediol oder Calcidiol) und damit die renale Vitamin D-Produktion stimuliert und auf diese Weise die Calciumresorption in Niere und Darm erhöht [12].
Daher steigt bereits in der Prädialyse reaktiv das PTH, weil die geschädigten Nieren nicht mehr genügend Vitamin D produzieren [13]. Darüber hinaus kann PTH den Phosphat-Efflux aus den Knochen erhöhen und stimuliert zusätzlich die Synthese des Peptidhormons Fibroblasten-Wachstumsfaktor 23 (FGF23) [14]. Ein hoher PTH-Spiegel führt ferner indirekt zur Reifung und Aktivierung der Osteoklasten und damit zu einer Calcium-Phosphat-Mobilisierung aus dem Knochengewebe, um Calciumdefizite im Blut auszugleichen [15].
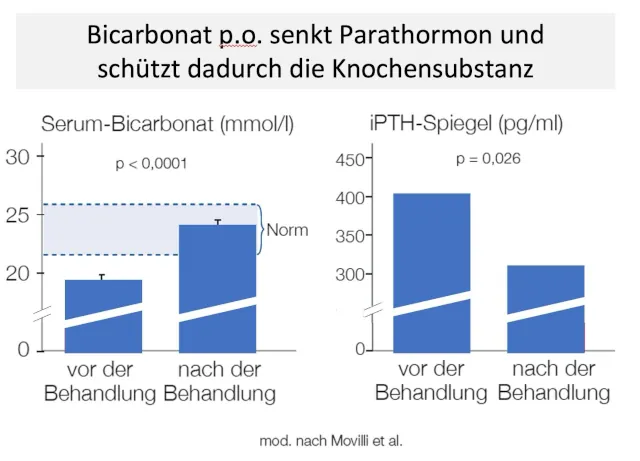
Gerät bei chronischer Niereninsuffizienz diese osteorenale Kommunikation aus dem Gleichgewicht sind zahlreiche therapeutische Konzepte zu bedenken und einzusetzen, Komorbiditäten wie erhöhter Blutdruck und Diabetes stringent zu behandeln und ein engmaschiges Screening durchzuführen, um eine Progression der Erkrankungen zu vermeiden [16].
Fibroblasten-Wachstumsfaktor 23 (FGF23)
FGF23 wird überwiegend von Osteozyten gebildet und inhibiert die renale tubuläre Reabsorption von Phosphat und erhöht damit die Urin-Phosphat-Ausscheidung. FGF23 reduziert die renale Phosphatrückresorption, indem es die apikale Expression des Natrium-abhängigen Phosphat-Kotransporters-IIa (NaPi-IIa) in der Bürstenmembran des proximal renalen Tublus hemmt
[17]. Die Expression und Aktivität dieser Transporter wird durch PTH, Calcitriol, Glukokortikoide, Phosphat und durch FGF23 reguliert
[18].
Erhöhte Phosphatspiegel stimulieren die Ausschüttung von FGF23 aus den Osteozyten und Osteoblasten, während erniedrigte Phosphatspiegel zu reduzierten FGF23-Werten führen. 1,25(OH)2D3 (aktives Vitamin D) stimuliert ebenfalls eine Ausschüttung von FGF23. Ferner hemmt FGF23 die Synthese des aktiven Vitamin D, indem es die 1αHydroxylase inhibiert. Dadurch sinkt der Calcitriolspiegel. Reduzierte Calcitriolspiegel wiederum verringern die intestinale Phosphat- und Calciumresorption [19]. Die Konzentrationen von FGF23 korrelieren ferner positiv mit der diätetischen Calciumzufuhr (p = 0.01), allerdings nicht nach akut erhöhter Calciumzufuhr [20].
Modeling und Remodeling von Knochen
Der Knochen adaptiert seine mechanische Funktion, das heißt seine Geometrie und damit die Knochenfestigkeit, ein Leben lang auf die täglichen Anforderungen. Das Modell Mechanostat von Harald Frost beschreibt die Dynamik des Knochenumbaus. Demnach wird Knochenwachstum und Knochenabbau durch die maximale elastische Verformung des Knochens bestimmt. Dabei sind die auftretenden kurzzeitigen Maximalkräfte entscheidend für den Umbau.
Diese Tatsache hat gerade auch für Knochenschwund therapeutische Konsequenzen: Geeignetes Training mit mechanischen Spitzenkräften auf den Knochen kann das Knochenwachstum stimulieren, die Knochenfestigkeit steigern und so einer Osteoporose entgegenwirken. Für den Knochenaufbau förderlich sind dynamische Übungen mit Krafteinsatz, ein Ausdauer-orientiertes Training (z.B. Laufen, Radfahren, Schwimmen) hat keinen (oder wenig) Einfluss auf die Knochenbildung, da die auftretenden Kraftspitzen zu gering sind. Bewährt hat sich vor allem das Vibrationstraining (auch Whole Body Vibration (WBV), Beschleunigungstraining, Schwingungstraining, Mechanostimulation oder stochastisches Resonanztraining).
Frost hat vier Bereiche der Knochenverformung, gemessen in μStrain, definiert:
Disuse: Strain < circa 800 μStrain: Remodeling (Knochenumbau und Knochenreparatur) findet statt, Knochenmasse und Knochenfestigkeit wird abgebaut.
Adapted State: Strain zwischen ca. 800 und 1.500 μStrain: Remodeling findet statt, Knochenmasse und Knochenfestigkeit bleiben unverändert.
Overload: Strain > ca. 1.500 μStrain: Modeling (Knochenaufbau) findet statt, Knochenmasse und Knochenfestigkeit werden vergrößert.
Fracture: Strain > ca. 15.000 μStrain: Bruchgrenze, der Knochen bricht.
1000 μStrain = entsprechen 0,1 % Längenänderung
Zu berücksichtigen ist hierbei, dass die Festigkeit des Knochens stark von der Geometrie und von der Richtung der Krafteinleitung abhängig ist. Die Tibia beispielsweise hat in axialer Richtung etwa eine Bruchgrenze vom 50- bis 60-fachen Körpergewicht. Senkrecht zu dieser Achse liegt die Bruchgrenze jedoch um den Faktor 10 oder mehr niedriger.
α-Klotho
Als weiterer Biomarker des Phosphat- und Vitamin D-Stoffwechsels bei frühen chronischen Nierenerkrankungen gilt das α-Klotho [21]. Es wird vorwiegend in der Niere als membranständiges Protein (TM-Klotho) und als zirkulierende lösliche Variante (s-Klotho) produziert. Eine tierexperimentelle Studie konnte in vivo durch Micropunktion und in vitro an proximalen Tubuluszelllinien zeigen, dass α-Klotho in den Nieren sezerniert wird und transcytotisch von der basalen zur apikalen Seite der proximalen Tubuluszellen migriert [22]. Daraus schließen die Autoren, dass die Niere zwei Aufgaben in der Aufrechterhaltung der α-Klotho-Homöostase hat: Produktion und Freisetzung sowie Clearing aus dem Blut in den Urin. α-Klotho fungiert als Cofaktor für den FGF23-Rezeptor und erhöht die Affinität für die FGF23-Bindung am Rezeptor.
Therapie der Osteoporose
Lebensstil-Änderungen und Ernährungsmaßnahmen bei Osteoporose
- Tägliche Kalziumzufuhr zwischen 800 und 1200 mg und ausreichend Nahrungsprotein, idealerweise über Milchprodukte.
- Bei postmenopausalen Frauen mit erhöhtem Frakturrisiko sollte eine tägliche Dosis von 800 IE Cholecalciferol empfohlen werden.
- Eine Kalziumergänzung ist angebracht, wenn die ernährungsbedingte Aufnahme unter 800 mg/Tag liegt und eine Vitamin-D-Supplementierung bei Patienten in Betracht gezogen wird, die ein Risiko für eine Vitamin-D-Insuffizienz haben oder Anzeichen einer solchen aufweisen. Achtung: Durch die Gabe von Kalzium in hohen Mengen kann die Ausscheidung mit dem Urin (Hyperkalziurie) ansteigen. Folge können Nierensteine oder eine Nephrokalzinose sein.
- Regelmäßige, auf die Bedürfnisse und Fähigkeiten der einzelnen Patienten zugeschnittene körperliche Belastung.
- Bei Personen mit erhöhtem Frakturrisiko sollte eine Sturz-Anamnese erstellt werden, wobei bei erhöhtem Risiko eine weitere Beurteilung und geeignete Maßnahmen durchgeführt werden sollten.
Quelle: Kanis, JA et al. Calcif Tissue Int. 2019 Mar; 104(3): 235–238. [9]
Pharmakologische Interventionen bei postmenopausalen Frauen
- Die oralen Bisphosphonate (Alendronat, Risedronat und Ibandronat) können in der Mehrzahl der Fälle als Erstbehandlung eingesetzt werden. Bei Frauen, die orale Bisphosphonate nicht vertragen (oder bei Frauen, bei denen sie kontraindiziert sind), stellen intravenöse Bisphosphonate oder Denosumab die am besten geeigneten Alternativen dar, wobei Raloxifen oder die Hormontherapie der Wechseljahre als zusätzliche Optionen zur Verfügung stehen. Teriparatid wird bevorzugt für Patienten mit hohem Frakturrisiko empfohlen.
- Die Therapie mit Bisphosphonat sollte nach 3 - 5 Jahren überprüft werden. Das Frakturrisiko sollte nach jedem Knochenbruch neu bewertet werden. Das Risiko von Wirbelkörpern-Frakturen steigt bei Patienten, die die Behandlung abbrechen.
- Das Absetzen einer Denosumab-Therapie ist mit einem Anstieg der Wirbelkörper-Frakturrate verbunden. Eine Bisphosphonat-Therapie kann nach Absetzen von Denosumab in Betracht gezogen werden.
- Es gibt kaum Anhaltspunkte für eine Entscheidungsfindung, die über 10 Jahre Behandlung hinausgeht. Daher sollten die medikamentöse Therapie und andere Behandlungsoptionen sowie der Therapieerfolg bei Osteoporose-Patienten auf individueller Basis regelmäßig geprüft werden.
Quelle: Kanis, JA et al. Calcif Tissue Int. 2019 Mar; 104(3): 235–238. [9]
Pharmakologische Interventionen bei Niereninsuffizienz und chronischer Azidose
Plasma-Bikarbonat ist mit der Knochenmineraldichte und der Knochenabbaurate (Knochenschwund) assoziiert. Das zeigt, dass der systemische Säure-Basen-Status eine wichtige Determinante der Skelett-Gesundheit während des Alterns ist [23, 24]:
Das Säure-Basen-Gleichgewicht wird wesentlich durch die Lunge und Nieren reguliert. Ferner neutralisieren körpereigene Puffersubstanzen, wie beispielsweise Bicarbonat, im Stoffwechsel anfallende Säuren und sind auf diese Weise an der Regulierung des pH-Wertes in Blut und Geweben beteiligt. Bei nicht normaler Regulierung verursacht die Anhäufung von Wasserstoffionen (H+) eine metabolische Azidose. Diese stört den Stoffwechsel von Knochen und Muskeln und kann darüber hinaus zu Anomalien bei der Freisetzung und Funktion verschiedener Hormone führen, darunter Wachstumshormone, IGF-1, Insulin, Glukokortikoide, Schilddrüsenhormone, Nebenschilddrüsenhormon und Vitamin D. Klinische Folgen dieser anormalen Stoffwechselreaktionen sind Wachstumsstörungen bei Säuglingen und Kindern sowie der Verlust von Knochen- und Muskelmasse bei Erwachsenen [25].
Die chronische metabolische Azidose und ihre Folgen können durch eine Behandlung mit Natriumhydrogenkarbonat (NaHCO₃ / kurz: Bikarbonat) korrigiert werden [25]. Dabei scheint Natriumhydrogenkarbonat die beste Alternative zu anderen Azidosetherapeutika zu sein, weil z. B.Patienten mit Nierensteinen andere alkalisierende Mittel wie z. B. Kaliumcitrat wegen der Nebenwirkungen (Hyperkaliämie und Magendarmstörungen) nicht vertragen können. Natriumbikarbonat erwies sich als ähnlich wirksam, kostengünstiger und nebenwirkungsärmer [26]. Das gilt insbesondere für magensaftresistente Präparate [27]. U. a. wegen gastrointestinaler Nebenwirkungen und besserer Bioverfügbarkeit empfiehlt eine interdisziplinäre Kommission, Bikarbonat ausschließlich in magensaftresistenter Galenik einzunehmen. Pharmakologisch sinnvoll sind dabei allerdings nur Präparate mit einer Galenik, die eine schnelle Freisetzung des Wirkstoffes im oberen Dünndarm gewährleisten, während eine retardierte langsame Freisetzung (slow release) unerwünscht auch untere Darmabschnitte alkalisieren kann.
Fazit: Osteoporose ist behandelbar
In der ärztlichen Praxis kommt Osteoporose relativ häufig bei postmenopausalen Frauen aber auch bei älteren Männern vor. Die Pathogenese ist vielfältig, von hormonellen Störungen, Nierenschwäche bis hin zu einer chronischen metabolischen Azidose. Die Therapie beinhaltet neben Änderungen des Lebenstils auch medikamentöse Interventionen. Dabei können auch Nahrungsergänzungsmittel sinnvoll sein (Kalzium, Vitamin D). Wenn eine Nierenschwäche vorliegt, ist aufgrund der mangelnden Ausscheidung von Säuren die chronische Azidose eine häufige Komplikation, die mit Azidosetherapeutike, wie Natriumbikarbonat, behandelt werden muss, um die Progression von Osteoporose, Niereninsuffizienz und Azidose zu stoppen oder zumindest abzumildern.